انواع خوردگی فلزات و نحوه حفاظت در برابر آنها
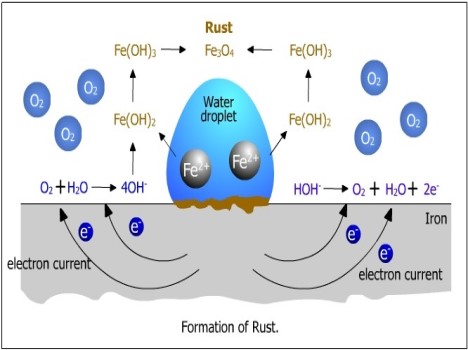
خوردگی فلزات یکی از رایجترین پدیدههایی است که آن را در زندگی روزمره تا بخشهای مختلفی از صنعت مشاهده میکنیم. حتماً متوجه شدهاید که برخی از اجسام ساختهشده از آهن در یک مقطع زمانی با یک لایه نارنجی یا قهوهای مایل به قرمز پوشیده شدهاند. تشکیل این لایه نتیجه فرآیند شیمیایی معروف به زنگزدگی است که نوعی خوردگی است.
بهمنظور بهبود کارایی مواد و قطعات در برابر خوردگی، انواع فولادهای ضدزنگ یا استیل توسعه داده شدند. قیمت استیل و انواع محصولات مرتبط با آن را در این لینک مشاهده نمایید.
خوردگی فلزات چیست و چگونه اتفاق می افتد ؟
از خوردگی فلزات اساساً بهعنوان یک فرآیند طبیعی یاد میشود که باعث تبدیل فلزات خالص به مواد نامطلوب در هنگام واکنش آنها با موادی مانند آب یا هوا میشود. این واکنش باعث آسیب و متلاشی شدن فلز میشود که از قسمت فلزی که در معرض محیط قرار دارد شروع میشود و به کل قسمت عمده فلز گسترش مییابد. خوردگی فلزات یک فرآیند خودبهخودی و غیرقابلبرگشت است که در آن فلزات به یک ترکیب شیمیایی بسیار پایدار مانند اکسیدها، سولفیدها، هیدروکسیدها و غیره تبدیل میشوند.
بهطورکلی خوردگی فرآیندی است که از طریق آن فلزات تصفیهشده به ترکیبات پایدارتری مانند اکسیدهای فلزی، سولفیدهای فلزی یا هیدروکسیدهای فلزی تبدیل میشوند. به همین ترتیب، زنگ زدن آهن شامل تشکیل اکسیدهای آهن از طریق عمل رطوبت و اکسیژن اتمسفر است.
خوردگی معمولاً یک پدیده نامطلوب است زیرا بر خواص مطلوب فلز تأثیر منفی میگذارد. بهعنوانمثال، آهن دارای استحکام کششی و سختی خوبی است (بهویژه بهصورت آلیاژ شده با چند عنصر دیگر). بااینحال، وقتی در معرض زنگزدگی قرار میگیرد، شکننده و پوستهپوستهشده و ازنظر ساختاری نامطلوب میشود.
از طرف دیگر، خوردگی یک فرآیند کنترلشده با نفوذ است و بیشتر در سطوح در معرض دید رخ میدهد. بنابراین در برخی موارد سعی میشود فعالیت سطح در معرض دید کاهش یابد و مقاومت در برابر خوردگی مواد افزایش یابد. بدین منظور، فرآیندهایی مانند غیرفعال سازی سطح و اعمال کرومات و پوشش دهی استفاده میشود. بااینحال، برخی مکانیزم های خوردگی همیشه قابلمشاهده نیستند و حتی کمتر قابل پیشبینی هستند.
همچنین، خوردگی فلزات را میتوان بهعنوان یک فرآیند الکتروشیمیایی نیز طبقهبندی کرد زیرا معمولاً شامل واکنشهای اکسایش و کاهش بین فلز و برخی عوامل جوی مانند آب، اکسیژن، دیاکسید گوگرد و غیره است.
آیا خوردگی در تمام فلزات اتفاق می افتد ؟
فلزاتی که در سری واکنشپذیری یا سری emf، در ردههای بالاتر قرار میگیرند مانند آهن، روی و غیره، خیلی راحت خورده میشوند (فلزات فعال) و فلزاتی که در سری emf پایینتر قرار میگیرند، مانند طلا، پلاتین و پالادیوم خورده نمیشوند (فلزات نجیب). دلیل آن در این واقعیت نهفته است که خوردگی شامل اکسیداسیون فلزات است. همانطور که در این جدول پایین میرویم، تمایل سری واکنش به اکسید شدن بسیار کم است (پتانسیل اکسیداسیون بسیار کم است).
جالب اینجاست که آلومینیوم برخلاف فلزات دیگر بهراحتی خورده نمیشود، حتی اگر واکنشپذیر باشد. این امر به این دلیل است که آلومینیوم از قبل توسط یک لایه اکسید آلومینیوم پوشیده شده است. این لایه از اکسید آلومینیوم از آن در برابر خوردگی بیشتر محافظت میکند. بااینحال این فلز نیز اگر بهخوبی محافظت نشود یا در معرض عوامل اکسیدکننده قوی قرار گیرد، دچار خوردگی میشود. خوردگی آلومینیوم و نحوه محافظت از آن را در این لینک بخوانید.
عوامل مؤثر بر سرعت خوردگی فلزات
عوامل متعددی بر سرعت خوردگی تأثیر میگذارند ازجمله سرعت نفوذ، دما، رسانایی، نوع یونها، مقدار pH و پتانسیل الکتروشیمیایی. سرعت خوردگی را میتوان با اعمال انواع پوششهای ضد خوردگی یا تکنیکهای محافظت در برابر خوردگی کنترل کرد یا کاهش داد.
سرعت نفوذ
در اکثر موارد، نرخ خوردگی فلزات با نفوذ واکنشدهندهها به سطح فلز و از طریق سطح فلز کنترل میشود. سطوح فولادی بدون پوشش با سرعت بیشتری خورده میشوند. نرخ خوردگی نیز بهشدت توسط نفوذ اکسیژن از طریق آب به سطح فولاد کنترل میشود.
در مناطقی که انتشار اکسیژن رایج است، به نظر میرسد خوردگی با سرعت بیشتری رخ میدهد. نواحی با جریان بالا، مانند مجاورت دهانه زنگ، به دلیل افزایش سطح اکسیژن، تمایل به نشان دادن نرخ خوردگی بالاتری دارند، اگرچه فرسایش نیز یک عامل است. نواحی پوشیده شده توسط یک لایه رطوبتی نازک و رسانا سریعتر از نواحی زیرین غوطهور خورده میشوند.
دما
همانطور که نرخ خوردگی توسط نفوذ تعیین میشود، نرخ نفوذ یا انتشار نیز توسط دما کنترل میشود. فولاد و سایر فلزات در دماهای بالاتر با سرعت بیشتری خورده میشوند. درنتیجه، نواحی زیر عرشه و مناطق مجاور موتورخانه یا مخازن بار گرم شده و سریعتر خورده میشوند.
رسانایی
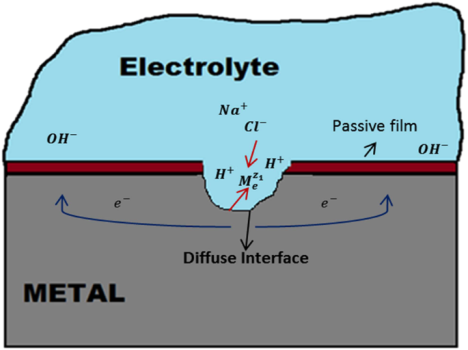
برای وقوع خوردگی باید یک محیط رسانا بین دو فلز یا ماده وجود داشته باشد. خوردگی فلزات در آب مقطر رخ نمیدهد و با افزایش رسانایی به دلیل وجود یونهای بیشتر در محلول، سرعت خوردگی افزایش مییابد. نرخ خوردگی فولاد به حداکثر مقدار یونی معمولی آب دریا نزدیک میشود. آب شیرین فولاد را به میزان کمتری نسبت به آب شور دچار خورنده میکند و معمولاً آب دریا بیشترین خورندگی را برای فولاد دارد.
نوع یون
برخی از انواع یونهای موجود در آب دریا یا در محمولهها خورندهتر از سایرین هستند. یونهای کلرید معمولاً مخربترین هستند و سولفات و سایر یونهای حاوی گوگرد نیز مشکلات عمدهای را ایجاد میکنند. یونهای کلرید اثر مخربی بر خواص محافظتی هرگونه زنگزدگی دارند که این امر را از طریق جلوگیری از تشکیل اکسیدهای محافظ به عمل میرسانند.
یونهای حاوی گوگرد در واکنشهای تولید الکترون اضافی در خود زنگ دخیل میشوند که بهنوبه خود فرآیندی چرخهای و خود- بازسازی را تشکیل میدهد. این میتواند حفرههای شدیدی را در کف داخلی مخازن بار در حاملهای نفت و فرآورده ایجاد کند. گوگرد میتواند هم از سیستم گاز بیاثر و هم از محمولههای حاوی گوگرد مانند نفت خامترش منشأ بگیرد.
مقدار pH
pH معیاری از اسیدی بودن یا قلیایی بودن در مقیاس ۱ تا ۱۴ است. در آب دریا خنثی، pH حدود ۷٫۵ است که به این معنی است که یونهای هیدروژن (اسید) و یون هیدروکسیل (قلیا) تقریباً در تعادل هستند. در چنین شرایطی، واکنشی که انحلال آهن را متعادل میکند، کاهش اکسیژن محلول برای تشکیل یونهای هیدروکسیل است.
بااینحال، اگر محیط اسیدیتر شود و pH به ۱ نزدیکتر شود، مقدار بیشتری یون هیدروژن نسبت به یونهای هیدروکسیل موجود در محلول وجود دارد. یونهای هیدروژن اضافی میتوانند در واکنش متعادلکننده (کاتدی) که منجر به تکامل گاز هیدروژن میشود، دخیل شوند. ازآنجاییکه هم یونهای هیدروژن و هم گاز هیدروژن میتوانند بهسرعت پخش شوند، فولاد میتواند سریعتر خورده شود. این یک اثر رایج هنگام حمل محمولههایی مانند پت-کک، گوگرد و روغنهای خامترش است.
پتانسیل الکتروشیمیایی
هر فلز وقتی در یک مایع رسانا غوطهور میشود پتانسیل الکتروشیمیایی خاصی را به خود اختصاص میدهد. این پتانسیل، پتانسیل نیمه سلولی نامیده میشود؛ زیرا تنها با مقایسه آن با پتانسیل مرجع شناختهشده دیگری که توسط یک الکترود مرجع تولید میشود قابلاندازهگیری است.
الکترودهای مرجع متداول عبارتاند از: الکترود کالومل اشباع (SCE)، نقره/کلرید نقره و الکترودهای مرجع سولفات مس/مس. پتانسیلی که یک فلز در محلول میگیرد میتواند تعیین کند که آیا فلز خورده میشود و اگر خورده میشود با چه سرعتی این اتفاق میافتد. پتانسیل را میتوان با اتصال آن به فلز غیرمشابه دیگری (مانند خوردگی گالوانیکی یا با استفاده از آندهای فداشونده) یا با اعمال یک پتانسیل خارجی تغییر داد.
رطوبت
رطوبت یکی از عوامل مهمی است که میتواند منجر به خوردگی شود. فلزات در محیطهای مرطوب خیلی سریعتر دچار خوردگی یا زنگزدگی میشوند.
کاربرد ایدئال برای فلزات، بهویژه فلزات غیر آلیاژی، در یک محیط خشک و غیر مرطوب است. بااینحال، گاهی اوقات شما به فلز در یک منطقه مرطوب نیاز دارید و این زمانی است که باید نوع فلزی را که استفاده میکنید در نظر بگیرید. استفاده از آلیاژهای فلزی میتواند برای جلوگیری از زنگزدگی مفید باشد.
نوع فلز
فلزات خالص معمولاً بیشتر از آلیاژهای فلزی در برابر خوردگی حساس هستند. یکی از مقاومترین آلیاژهای فلزی برای مصارف خانگی در برابر خوردگی، فولاد ضدزنگ است. اگر وسایل شما از فولاد ضدزنگ ساختهشده باشند، بعید است در طول عمر دستگاه زنگ بزنند. این آلیاژ بهطور خاص برای مقاومت در برابر زنگزدگی حتی در محیطهای مرطوب طراحی شده است.
انواع خوردگی فلزات
خوردگی پدیدهای است که به روشها و مکانیزهای مختلفی بر خواص و کارایی مواد تأثیر میگذارد. بهمنظور جلوگیری از این پدیده ابتدا باید با انواع خوردگی و مکانیزهای هر یک آشنا شویم.
خوردگی گالوانیکی یا خوردگی دو فلزی
این نوع خوردگی، یک از رایجترین نوع خوردگی فلزات است. هنگامیکه یک تماس الکتریکی بین دو فلز وجود داشته باشد که ازنظر الکتروشیمیایی غیرمشابه هستند و در یک محیط الکترولیتی قرار دارند، خوردگی گالوانیکی یا دو فلزی میتواند ایجاد شود. این امر منجر به تخریب یکی از این فلزات در یک اتصال یا در محل اتصال آنها میشود.
یک مثال خوب از این نوع خوردگی، تخریبی است که هنگام تماس مس در محیط آب شور با فولاد رخ میدهد. همچنین، وقتی آلومینیوم و فولاد کربنی به هم متصل میشوند و در آب دریا غوطهور میشوند، آلومینیوم سریعتر خورده میشود و فولاد محافظت میشود.

خوردگی شکافی یا خوردگی شیاری
هرگاه در غلظت یونی بین هر دو ناحیه فلز تفاوت وجود داشته باشد، شکل موضعی خوردگی به نام خوردگی شکافی ممکن است رخ دهد. در یک مثال ساده، این شکل از خوردگی بیشتر در فضاهای محدود (شکاف) رخ میدهد. نمونههایی از مناطقی که در آن خوردگی شکافی ممکن است رخ دهد، واشرها، سطح زیرین واشرها و سرپیچها هستند.
تمام گریدهای آلیاژهای آلومینیوم و فولادهای ضدزنگ نیز دچار خوردگی شکافی میشوند. این امر عمدتاً به دلیل تشکیل یک سلول هوادهی تفاضلی است که منجر به تشکیل خوردگی در داخل شکافها میشود.
شیار هیدروژنی
این خوردگی اغلب در لولهها اتفاق میافتد و عامل آن شیارهایی است که در اثر برهمکنش یک عامل خورنده ایجاد میشوند. بر این اساس، اجزای لوله خورده شده و حبابهای گاز هیدروژن ایجاد میشوند. حبابها معمولاً پوشش محافظ را پس از تماس با مواد جدا میکنند.
خوردگی حفره ای
خوردگی حفرهای بسیار غیرقابلپیشبینی است و بنابراین تشخیص آن دشوار است و یکی از خطرناکترین انواع خوردگی در نظر گرفته میشود. این نوع خوردگی در یک نقطه محلی رخ میدهد و با تشکیل یک سلول خوردگی که توسط سطح فلزی معمولی احاطه شده است، ادامه مییابد.
هنگامیکه این حفره تشکیل شد، به رشد خود ادامه میدهد و میتواند اشکال مختلفی به خود بگیرد. حفره بهآرامی از سطح در جهت عمودی به فلز نفوذ میکند و درنهایت منجر به شکست ساختاری میشود که کنترل نشده باقی مانده است.
خوردگی یکنواخت
این نوع خوردگی فلزات، رایجترین شکل خوردگی در نظر گرفته میشود که در آن حمله به سطح فلز توسط اتمسفر انجام میشود. میزان خوردگی بهراحتی قابلتشخیص است. این نوع خوردگی تأثیر نسبتاً کمی بر عملکرد مواد دارد. در خوردگی یکنواخت، تمام سطح قطعه با سرعتی ثابت و به یک شکل خورده میشوند.
ترک ناشی از خوردگی تنشی (SCC)
Stress Corrosion Cracking را میتوان بهاختصار SCC نامید و به ترکخوردگی فلز درنتیجه محیط خورنده و نیروی کششی قرارگرفته روی فلز اشاره دارد. این نوع خوردگی اغلب در دمای بالا رخ میدهد. بهعنوانمثال، میتوان به ترکخوردگی تنشی فولاد زنگ نزن آستنیتی در محلول کلرید اشاره کرد.

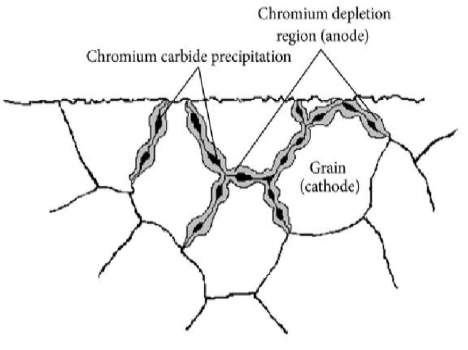
خوردگی بین دانه ای یا خوردگی مرزدانه ای
خوردگی بیندانهای به دلیل وجود ناخالصی در مرزهای دانه رخ میدهد که دانههای تشکیلشده در طول انجماد آلیاژ فلز را جدا میکند. همچنین میتواند از طریق تخلیه یا غنی شدن آلیاژ در این مرزهای دانه رخ دهد.
خوردگی میکروبی
خوردگی میکروبی که بهعنوان خوردگی تحت تأثیر میکروبیولوژیک (MIC) نیز شناخته میشود، نوعی خوردگی است که توسط میکروارگانیسمها ایجاد میشود. شایعترین آنها کمواتوتروف ها هستند. مواد فلزی و غیرفلزی چه در حضور یا عدم حضور اکسیژن میتوانند تحت تأثیر این خوردگی قرار گیرند.
خوردگی دما بالا
خوردگی در دمای بالا همانطور که از نام آن پیداست نوعی خوردگی فلزات در اثر حرارت است. تخریب شیمیایی فلز میتواند به دلیل اتمسفر گرمی که حاوی گازهایی مانند اکسیژن، گوگرد یا سایر ترکیبات است رخ دهد. این ترکیبات قادرند فلزات را بهراحتی اکسید کنند. بهعنوانمثال، مواد مورداستفاده در موتورهای خودرو باید در دورههای پایدار در دماهای بالا مقاومت کنند که در طی آن میتوانند تحت تأثیر اتمسفر حاوی محصولات خورنده احتراق قرار گیرند.
روش های محافظت و جلوگیری از خوردگی فلزات
جلوگیری از خوردگی بهمنظور جلوگیری از تلفات هنگفت از اهمیت بالایی برخوردار است. اکثر سازههایی که میبینیم و استفاده میکنیم از فلزات ساختهشدهاند. اینها شامل پلها، خودروها، ماشینآلات، کالاهای خانگی مانند کورههای پنجره، درها، خطوط راهآهن و غیره میشود.
درحالیکه این موضوع نگرانکننده است، چندین روش جلوگیری و یا حفاظت بهمنظور کاهش آسیب خوردگی در اجسام فلزی استفاده میشود. این بهویژه در مورد موادی انجام میشود که اغلب در معرض آبوهوا، آب شور، اسیدها یا سایر محیطهای متخاصم هستند.
برخی از روشهای رایج برای جلوگیری از خوردگی عبارتاند از:
- آبکاری
- گالوانیزه کردن
- آنودایز کردن
- غیرفعال کردن سطح
- پوششهای بیوفیلم
- پوششهای محافظ ضد خوردگی
- رنگآمیزی و گریس کاری
- استفاده از بازدارندههای خوردگی یا عوامل خشککننده
- تمیز کردن دورهای سطح فلز
بهمنظور آشنایی با اینکه فرآیند آنودایز کردن چیست ، به این لینک مراجعه نمایید. این فرآیند یکی از روشهای متداول بهبود خواص مواد جهت بهبود مقاومت به خوردگی است.
جمع بندی
خوردگی فلزات یک پدیده طبیعی و خودبهخودی و برگشتناپذیر است. این پدیده میتواند تأثیرات مختلفی را بر بسیاری از چیزها داشته باشد. بهاینترتیب عمدتاً باعث هدر رفتن منابع طبیعی میشود. علاوه بر این، میتواند موقعیتهای خطرناکی مانند ضعیف و ناپایدار شدن سازههای ساختمان، حوادث ناشی از خوردگی قطعات و همچنین سایر خرابیهای ناخواسته مانند ترکخوردگی خطوط لوله، فروریختن پل، تصادف وسایل نقلیه حملونقل یا سایر فجایع را ایجاد کند. بنابراین بررسی و جلوگیری از وقوع خوردگی یا کاهش اثرات آن اهمیت بسیار زیادی دارد.







دیدگاهتان را بنویسید